Аміни — нітрогеновмісні органічні хімічні сполуки, похідні амоніаку (NH3), в якому атоми Гідрогену заміщені однією чи багатьма групами інших атомів — вуглеводневими радикалами.
Якщо амін створений заміщенням одного атома Гідрогену в NH3, він називається первинним аміном (формула RNH2), якщо двох — вторинним аміном (R2NH), а якщо трьох — третинним аміном (R3N). Четвертинні аміни мають чотири замісники при атомі нітрогену, внаслідок чого атом Нітрогену в цих амінах має електричний заряд +1.
Найважливішим ароматичним аміном є анілін.
Номенклатура. Назви первинних амінів складаються з назви вуглеводню із закінченням -амін. Цифрою після назви вказують положення аміногрупи. Використовуються також назви амінів як похідних вуглеводнів із замісником аміногрупою –NН2:
СН3–NН2 метиламін, (СН3)3N – триметиламін.
Аміни – полярні сполуки, які, за винятком третинних, утворюють міжмолекулярні водневі зв'язки. Усі аміни з водою утворюють водневі зв’язки. Радикали та аміногрупи взаємно впливають один на одного.
Аліфатичні аміни є сильнішими основами, ніж аміак, ароматичні – слабкішими внаслідок різних індукційних ефектів радикалів.
В ароматичних амінів із збільшенням числа вуглеводневих радикалів основність слабшає, а в аліфатичних – посилюється.
За посиленням основних властивостей аміак, первинні, вторинні, третинні аліфатичні та ароматичні аміни можна розташувати у такій послідовності:
Фізичні властивості. Температури плавлення та кипіння амінів вищі, ніж неполярних сполук з тією ж молекулярною масою, але нижчі, ніж спиртів або карбонових кислот.
Метанамін, диметиламін, триметиламін – гази, добре розчинні у воді, мають запах аміаку. Середні члени гомологічного ряду – рідини, вищі – тверді речовини з запахом риби, нерозчинні у воді.
Хімічні властивості. Аміни за хімічними властивостями подібні до аміаку. Для них характерні основні властивості.
Основні властивості
1. Взаємодія з водою. Аміни розчиняються у воді, утворюючи іон алкіламонію
Внаслідок цього водні розчини амінів мають лужну реакцію. Вони змінюють колір індикаторів: фенолфталеїну – на малиновий, лакмусу – на синій. Іон алкіламонію має таху ж будову, як іон амонію. Це – комплексний тетраедричний іон, у якому азот є чотиривалентним зі ступенем окислення -3.[RNH3]+, то супроводжується появою у розчині гідроксид - іонів:
2. Взаємодія з кислотами. Аміни, як і аміак, реагують з мінеральними кислотами, утворюючи солі:
3. Горіння. На відміну від аміаку аміни горять на повітрі (згадайте, за яких умов горить аміак):
Одержання. Аміни добувають відновленням нітросполук.
Під дією водню нітросполуки відновлюються до амінів:
R–NO2 + 6Н = R–NH2 + 2Н2O.
Анілін – представник первинних ароматичних амінів. Молекулярна формула аніліну С6Н5NH2.
Номенклатура. Вживаються ще такі назви аніліну – бензоламін і феніламін.
Будова молекули. Електронна та структурна формули аніліну мають такий вигляд:
Фізичні властивості. Анілін – безбарвна масляниста дуже отруйна рідина з характерним запахом, малорозчинна у воді. На повітрі вона темніє внаслідок окислення.
Хімічні властивості. Основні властивості. Анілін – слабка основа. Він не взаємодіє з водою, його водні розчини не змінюють забарвлення індикаторів.
1.З сильними кислотами анілін утворює солі:
Демонстраційний дослід "Взаємодія аніліну з хлоридною кислотою"
2. З бромною водою
Демонстраційний дослід "Взаємодія аніліну з бромом"
Одержання. Метод добування аніліну відновленням нітробензолу, відкритий у 1840 р. російським вченим М. Зініним (1812–1880), мав велике значення для розвитку хімії та хімічної промисловості.
Схематично реакцію Зініна можна зобразити рівнянням:
Амінокислоти — це нітрогеновмісні органічні речовини, у молекулах яких містяться аміногрупа -NH2 і карбоксильна група -COOH, з’єднані з вуглеводневим радикалом.
Загальна формула амінокислот— H2N-R-COOH.
За систематичною номенклатурою назви амінокислот утворюються з назв відповідних кислот шляхом додавання префікса аміно- й зазначенням місця розташування аміногрупи відносно карбоксильної групи.
Для α-амінокислот R-CH(NH2)COOH, які відіграють винятково важливу роль у процесах життєдіяльності тварин і рослин, застосовуються тривіальні назви.
Найпростіший представник класу амінокислот має формулу H2N-CH2-COOH — аміноетанова (або амінооцтова) кислота (або гліцин)— перший член гомологічного ряду одноосновних насичених амінокислот.
Фізичні властивості:
За фізичними властивостями амінокилоти — білі кристалічні речовини, добре розчинні у воді, багато які з них мають солодкий смак.
Амінокислоти дуже поширені в природі. Це цеглинки, з яких побудовані всі рослинні й тваринні білки.
Хімічні властивості:
Амфотерність. Амінокислоти виявляють подвійну хімічну функцію: основну та кислотну, тобто вони є амфотерними органічними сполуками. Від неорганічних амфотерних сполук вони відрізняються тим, що їх кислотні та основні властивості обумовлені різними групами.
Розчини амінокислот, які містять у молекулах однакове число аміно- та карбоксигруп, нейтральні і не впливають на забарвлення індикаторів. Розчин моноамінодикарбонової кислоти мас кислу реакцію (змінює колір індикаторів як кислота), а диаміномонокарбонової – лужну (змінює колір індикаторів як луг).
Кислотні властивості.
1. За наявності лугів амінокислоти виявляють звичайні властивості кислот і утворюють солі:
Основні властивості
2. Амінокислоти виявляють властивості органічних основ і з сильними мінеральними кислотами утворюють солі:
Важлива властивість амінокислот — здатність взаємодіяти одна з одною завдяки наявності двох функціональних груп.
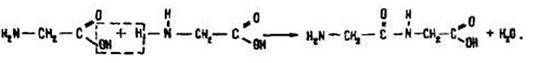
Міжмолекулярна взаємодія а-амінокислот приводить до утворення пептидів.
3. У результаті взаємодії двох а-амінокислот утворюється дипептид.
Фрагменти молекул амінокислот, що утворюють пептидний ланцюг, називаються амінокислотними залишками, а зв’язок CO - NH — пептидним зв’язком.
Білки — високомолекулярні сполуки. Найважливіші природні полімери — білки — належать до поліпептидів, тобто являють собою продукт поліконденсації а-амінокислот.
Лабораторний дослід "Біуретова реакція"
Лабораторний дослід "Ксантопротеїнова реакція"
1. Взаємодія з водою. Аміни розчиняються у воді, утворюючи іон алкіламонію
R–NO2 + 6Н = R–NH2 + 2Н2O.
2. З бромною водою
Демонстраційний дослід "Взаємодія аніліну з бромом"
Одержання. Метод добування аніліну відновленням нітробензолу, відкритий у 1840 р. російським вченим М. Зініним (1812–1880), мав велике значення для розвитку хімії та хімічної промисловості.
1. За наявності лугів амінокислоти виявляють звичайні властивості кислот і утворюють солі:
2. Амінокислоти виявляють властивості органічних основ і з сильними мінеральними кислотами утворюють солі:
Міжмолекулярна взаємодія а-амінокислот приводить до утворення пептидів.
3. У результаті взаємодії двох а-амінокислот утворюється дипептид. Білки — високомолекулярні сполуки. Найважливіші природні полімери — білки — належать до поліпептидів, тобто являють собою продукт поліконденсації а-амінокислот.
Лабораторний дослід "Біуретова реакція"
Лабораторний дослід "Ксантопротеїнова реакція"








Немає коментарів:
Дописати коментар